Új korszakot hoz el a genetika svájci bicskája

További Egészség cikkek
- Magyarországon egyelőre nem lesz legális az orvosi marihuána
- Hadat üzennek a spanyolok a homeopátiának
- Akár 20 évvel is képesek késleltetni az orvosok a menopauzát
- Csokoládét vagy kávét kell szagolni, ha le akar szokni a dohányzásról
- Sejtekkel és véredényekkel is rendelkező szívet nyomtattak izraeli tudósok
Ezek monumentális pillanatok az orvosbiológiai kutatás történetében. Ilyesmi nem történik minden nap
– mondta David Baltimore, az MIT molekuláris biológusa A CRISPR-Cas9-ről, amelyet mások az évszázad biotechnológiai felfedezésének tartanak. Nem csoda, hiszen ezzel az eszközzel a DNS szerkeszthetővé válik, nem kívánt darabkákat lehet vele kivágni, vagy akár kicserélni más szegmensekkel. Ez forradalmasíthatja a betegségek kezelését, és úgy általában is meghatározza a genetika jövőjét. A Wired egyszerűen csak a „Teremtés motorjának” nevezi, mert „közvetlen hozzáférést ígér az élet forráskódjához”.
A Science folyóirat már 2013-ban az év legfontosabb tudományos felfedezései közé választotta, és idén több nagy visszhangot kapott kísérlet is fűződik hozzá. Márciusban a Harvard tudósai beültették egy mamut néhány génjét egy elefánt DNS-ébe, áprilisban pedig ugyanezzel a módszerrel kínai kutatók
elég nagy tudományos vihart kavarva ezzel. A szakma már ezt megelőzően is elővigyázatosságra intett, márciusban több aggódó tudóscsoport is felszólalt az ellen, hogy a módszert a közeljövőben az emberi genomon is kipróbálják. Már az akkori felszólalásoknak is az volt az előzménye, hogy ilyen irányú kínai kísérletekről lehetett hallani. Ezek a pletykák igazolódtak be az új tanulmány megjelenésével, és állítólag legalább négy különböző kínai csoport dolgozik most is hasonló projekten.
A Sun Yat-sen Egyetem kutatói is tisztában voltak az etikai aggályokkal, ezért életképtelen embriókkal dolgoztak. Egy halálos vérképzőszervi rendellenességet okozó gént próbáltak megváltoztatni, de nagyon alacsony sikerességi arányt értek csak el, ráadásul sok nem tervezett mutációt is találtak a manipulált magzatokban.
Mindez mutatja, hogy a CRISPR-Cas9 egyelőre nem bizonyult olyan hatékonynak élő emberi szervezetben, mint a kémcsövek kontrollált világában, a gyakorlati alkalmazása az emberi szervezetben még odébb van. Főleg, hogy sok előnye mellett a módszer még nem elég pontos, és a tudósoknak valahogy meg kell birkóznia a beavatkozás nem szándékolt hatásaival is, mielőtt továbböröklődő változásokat okoznának.
Jó alaposan meg kellene gondolnunk, hogyan fogjuk használni ezt a hatalmat
– mondta Stanley Qi, a Stanford rendszerbiológusa is.
A sofőr és a bombaszakértő
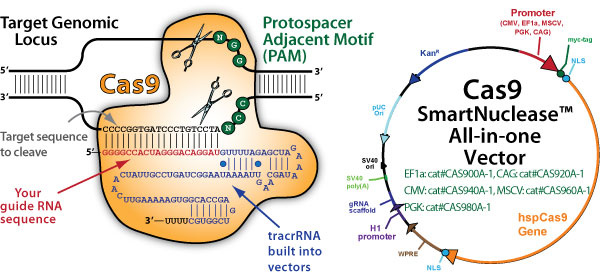
A módszer becsületes neve CRISPR-Cas9, mert két összetevőből áll össze:
- a CRISPR az információt szállító és a célt belövő RNS,
- a Cas9 pedig az az enzim, amely magát a vágást végzi.
A CRISPR-szekvenciákat (Clustered Regularly Interspaced Short Palindromic Repeats, vagyis csoportos, szabályosan megszakított rövid palindróm ismétlések) már 1987-ben felfedezték egyes baktériumokban. A kutatók először csak olyan ismétlődő szekvenciákat azonosítottak, amelyek megegyeztek a baktériumokat megtámadó vírusok egyes DNS-szekvenciáival. Később azt vették észre, hogy ha egy adott baktériumban megtalálható volt ilyen egyező szakasz, akkor vissza is tudott támadni a vírus ellen.
Ehhez a visszatámadáshoz van szükség a Cas9-re. Amikor a baktérium érzékeli, hogy egy vírus DNS-e jutott a szervezetébe, a DNS-sel egyező irányító RNS (gRNS) összeáll a Cas9 nevű nukleázzal (DNS-elvágó enzimmel), és az így létrejövő enzimkomplex lesz az, amely a módosításokat képes lesz végrehajtani. Amikor az irányító RNS iránytűként megtalálja a célpontját (az egyező részt) a vírus DNS-én, a Cas9 mindkét DNS-szálat elvágja, ezzel semlegesíti a vírust.
A kutatók rájöttek, hogy ha úgy tudják módosítani az irányító RNS-t, hogy az passzoljon egy általuk kiszemelt DNS-szekvenciával, akkor ezzel rávehetik a Cas9-et, hogy az apró molekuláris ollóival bármilyen DNS bármelyik szakaszát ki tudja vágni, amelyre épp ráeresztik. A végeredmény egy egyszerűen programozható génszerkesztő bioszerszám volt, amely
A szakadást a sejt megpróbálja javítani, de ez könnyen hibákhoz, mutációkhoz vezet, ami hatástalanítja a gént. A kutatók azonban a kivágott rész helyére bejuttathatnak egy általuk meghatározott szekvenciát, így ez fog beépülni a DNS-be. A korábbi módszerekkel szemben a CRISPR-Cas9 egyszerre több gént is képes célba venni, ami nagy előny az olyan összetettebb betegségek esetében, amelyeket nem egy, hanem több gén együttesen okoz. Ráadásul mindez nemcsak egy kémcsőben, de akár egy élő sejten belül is kivitelezhető.
Ha nem tudományos folyóiratokban, hanem gengszterfilmben szerepelnének, a CRISPR lenne az akciót kitervelő sofőr, a Cas9 pedig a nehézfiú, aki elvágja a bomba megfelelő drótjait, hogy ne robbanjon fel az egész banda.
Nagyon patent, de kié a patent?
Az első eredményeket a CRISPR-Cas9 módszerről Jennifer Doudna és Emmanuelle Charpentier csapata publikálta 2012-ben, a Science folyóiratban. Ez egy csapásra fel is forgatta a génkutatást: megsokszorozódott a CRISPR-rel foglalkozó kutatások száma, Doudnáék pedig díjakat nyertek és elismeréseket gyűjtöttek be. Pedig egy másik csapat az MIT-n, Feng Zhang vezetésével szintén ezen a módszeren dolgozott már 2012-ben, mikor megjelent a babérokat learató tanulmány.
Nem éreztem semmit. A mi célunk a genom editálása volt, ez a tanulmány pedig nem érte ezt el
– mondta Zhang a lemaradásról. Ő akart lenni viszont az első, aki az emberi genomon is kipróbálja a módszert.
Óriási verseny kezdődött. A Science 2013. januári számában jelent meg Zhangék módszere az emberi genom CRISPR-Cas9-féle módosítására. Ugyanebben a számban publikálta a maga kutatását ugyanerről George Church a Harvardról. Szintén ugyanebben a hónapban jelent med Doudnáék módszere is. Ahogy a Nature infografikájából is látszik, 2013-ban az új módszer már teljesen elszívta a tudományos élet levegőjét a korábbi módszerek elől, és ezzel párhuzamosan a pénz is elkezdett vödörrel ömleni bele.
Hiába indította el Doudna hónapokkal korábban a szabadalmi eljárást, egy gyorsított kérelemnek köszönhetően végül mégis Zhangék nyerték el a szabadalmat. Ennek a presztízsen kívül is bőven van jelentősége, hiszen ezentúl bárki, aki ezzel a módszerrel akar dolgozni, kénytelen lesz licencdíjat fizetni a jogtulajdonosnak. Tekintve, hogy forradalmi eljárásról van szó, amelynek a felhasználása rohamosan nő,
Éppen ezért a dolog még nem dőlt el, többen is megtámadták Zhangék szabadalmát, ellenbeadványok és fellebbezések születtek. A jogi csatározásoknak év vége felé lehet csak vége, ekkorra ígért újabb döntést az amerikai szabadalmi hivatal. De a huzavona nem akadályozta meg, hogy már eddig is gombaszerűen szaporodjanak a CRISPR-Cas9 technológiára építő cégek, és sok millió dollárnyi kockázati tőkét vonzzanak be a területre.
A genetika svájci bicskája
A lelkesedés érthető, hiszen míg a korábbi módszereket csak már alaposan megismert élőlények génállományán lehetett alkalmazni, addig a CRISPR-Cas9 a genetika svájci bicskája, elvileg bármilyen élőlényen alkalmazható. Ezért a kutatások is hatalmas területet fednek le.

A mezőgazdaságban például folynak a kísérletek a növények ellenállóbbá tételére. A búzát már sikerült megvédeni a lisztharmat nevű gombás fertőzéstől. Ugyanígy invazív fajok visszaszorítására is alkalmazható lehet a módszer. De a legfontosabb szerepe az emberre közvetlenül is alkalmazható kutatásokban lesz a CRISPR-Cas9-nek. Arról már írtunk is, hogy az egyre fenyegetőbb antibiotikum-rezisztenciát hogyan szoríthatná vissza, ha sikerülne kivágni a baktériumok ellenállásért felelős génjeit.
Ennél azonban előrébb járnak az orvosbiológiai kutatások, amelyek arra keresik a választ, hogy hogyan gyógyítható egy-egy betegség, vagy hogy miért működik egy gyógymód bizonyos géneknél, míg másoknál nem. Mindez hatékonyabb gyógyszerek létrehozásához vezethet. A módszer általában is jelentősen felgyorsítja az állatkísérleteken alapuló kutatásokat, de ennek már konkrét eredményei is vannak, sikeresen gyógyítottak vele például genetikai rendellenességeket egerekben. Az AIDS kezelésében is áttörést várnak tőle, akár azzal, hogy kiütik a gént, amely segít a betegség kialakulásában a HIV-vírusból; akár magának a vírusnak az eltávolításával.
A legutóbbi nagy eredmény pedig egészen friss. Július végén a Kaliforniai Egyetemen egy kutatócsoportnak sikerült módosítania az immunrendszer működésében kulcsszerepet játszó T-limfocitákat. Ez volt az első alkalom, hogy új szekvenciák beillesztésével sikerült kijavítani a T-limfociták mutációit.
Ráadásul egy szintén júliusi tanulmány még az eddiginél is olcsóbbá és egyszerűbbé tette az eljárást az irányító RNS-ek könnyebb előállításával.
A nagy hatalommal mutánsapokalipszis jár
A sok áttörés és forradalmi eredmény közepette azonban a CRISPR-Cas9 rengeteg súlyos problémát is felvet. Azzal, hogy minden eddiginél egyszerűbbé teszi a génmanipulációt, soha nem látott könnyedséggel lenne képes katasztrófát is okozni. Nagy hatalmú eszközről van szó, márpedig a Pókember óta tudjuk, hogy a nagy hatalommal nagy felelősség jár.
A legnagyobb veszélyt a beavatkozások nem szándékolt következményei jelentik. A CRISPR-Cas9 végre kivitelezhetővé tehet például egy először tíz évvel ezelőtt felmerült módszert, amellyel a kutatók bizonyos géneket szándékosan tudnak villámgyorsan elterjeszteni állatok egy egész populációjában. Ezzel az irányított láncreakcióval lehetővé válna a szúnyogok tömeges génmanipulációja, amivel a tudósok gyakorlatilag eltörölhetnének olyan súlyos betegségeket, mint a malária vagy a dengue-láz.
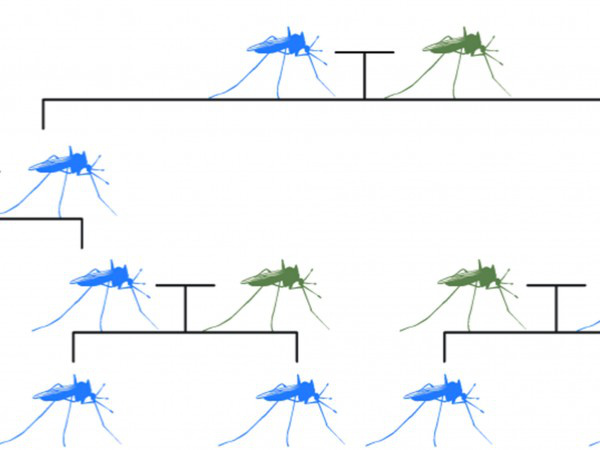
Azonban nem tudhatjuk biztosan, hogy a bevezetett mutáció nem szabadul-e ki az adott populációból és terjed át másik fajra. További kockázat, hogy ha nagy számú szúnyog eltűnik, kérdéses, hogy a velük táplálkozó állatokra, például a denevérekre milyen hatással lesz a változás. A tudósoknak sok ilyen kérdést kell még megválaszolniuk, mielőtt élesben bevetnék az ehhez hasonló módszereket. Hiába járnának ugyanis rengeteg pozitív hatással,
még mindig ott a lehetőség, hogy az evolúció olyan irányba viszi el a rendszert, amelyet nem terveztünk
– mondta James Collins evolúciós ökológus.
Egy másik példa, hogy a génmódosított élelmiszerek szabályozásában is felfordulást okozhat a módszer, mert nehezebbé teszi a módosítások azonosítását. A szabályozók ezért attól tartanak, hogy kicsúszhat a kezükből a haszonnövények és -állatok genetikai manipulációjának kordában tartása. És ezektől a példáktól kezdve a vérszomjas mutánsok létrehozásán át a fajspecifikus biofegyverekig lehet vérmérséklet szerint válogatni a szörnyűségek közül.
A CRISPR kivágja a DNS-t. Chuck Norris kivágja a CRISPR-t
Vicces példa a kedélyek lehűtésére Twitteren a #crisprfacts hashtag. Akkor indult be, mikor a Wired egyszerre örömódát zengő és apokalipszist vizionáló cikkével kapcsolatban a Harvard egyik genetikusa jegyezte meg, hogy picit talán túltolta a hype-ot. És azóta nincs megállás, Boromirtól Ned Starkon át Chuck Norrisig mindenki elmondja a magáét a genetikáról.
One does not simply edit the human germline #crisprfacts #GMhumans pic.twitter.com/KwNIinsPK3
— Genetics and Society (@C_G_S) 2015. július 22.
Jennifer Doudna mesélte el például, hogyan öntötte el az aggodalom egy 2014-es konferencia egyik előadásán. A kutatók egy belélegezhető vírussal juttattak génmutációt okozó CRISPR-t egerekbe, és létrehozták bennük az emberi tüdőrák modelljét. A cél a modell vizsgálhatósága volt, de ez a kutatás jól mutatja, miért van szükség a legegyszerűbb kísérlet esetében is óriási elővigyázatosságra: Doudna szerint egy apró hiba az irányító RNS tervezésében, és véletlenül emberre is hatásos “belélegezhető tüdőrákot” kapunk.
Az ilyen génkutatási áttörések után pedig kikerülhetetlen, klasszikus vita a dizájnerbabák témája is, az önkényes nemi szelekciótól a szabadon választott szemszínig, arcformáig, stb. A kérdés itt is az, hogy hol a határ, hiszen hosszú az út a halálos betegségek kivédése és a szülők kénye-kedve szerint ki-bepakolgatott tulajdonságok között, és sok a köztes állomás. Persze a CRISPR-Cas9 most még nem áll azon a szinten, hogy ez valós probléma legyen, tehát mindez nem azt jelenti, hogy kezdhetünk menekülni a mutáns vérszúnyogok elől, vagy tervezgetni a gyerek orrának a formáját. Azt viszont igen, hogy
Egyik oldalon tehát ott a CRISPR-Cas9 hihetetlen rugalmassága és könnyedsége, a másikon viszont a feltérképezetlen mellékhatásai és az egyelőre elég nagy hibaszázaléka. Katrine Bosley, az Editas nevű cég vezetője szerint ez a képlet azt a szokatlan helyzetet eredményezi, hogy nem a módszer működőképességéről kell meggyőzniük az ügyfeleiket, hanem ellenkezőleg, azt kell elérniük, hogy a hype és a nagy lehetőségek közepette reális kép alakuljon ki az eljárásról.



