További Egészség cikkek
- Magyarországon egyelőre nem lesz legális az orvosi marihuána
- Hadat üzennek a spanyolok a homeopátiának
- Akár 20 évvel is képesek késleltetni az orvosok a menopauzát
- Csokoládét vagy kávét kell szagolni, ha le akar szokni a dohányzásról
- Sejtekkel és véredényekkel is rendelkező szívet nyomtattak izraeli tudósok
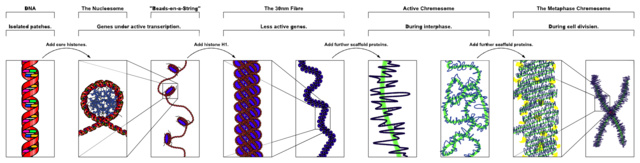
A biológiai információ átadását egyik generációtól az azt követő generációnak az örökítőanyag teszi lehetővé. A prokarióták és eukarióták, így az ember genetikai információját (genom) is hordozó vegyület a DNS (dezoxiribonukleinsav). A DNS jól ismert, kettős spirál alakja lehetővé teszi az információ majdnem tökéletes tárolását, megkettőződését és átadását. A DNS kémiai szerkezete magában rejti az evolúcióban fontos szerkezetváltozás lehetőségét is.
A sejtekben található DNS fehérjék segítségével a kromoszóma nevű makromolekulába rendeződik. Ezek a kromoszómák tartalmazzák az egyes szervezetek genetikai információinak nagy részét. A kromoszómák száma fajonként nagyon eltérő lehet, az emberben és a nyúlban például 46 darab (23 pár), a csimpánzban 48, míg a muslicában 8, egy boglárkafajban pedig közel 380 van.
Eltörik
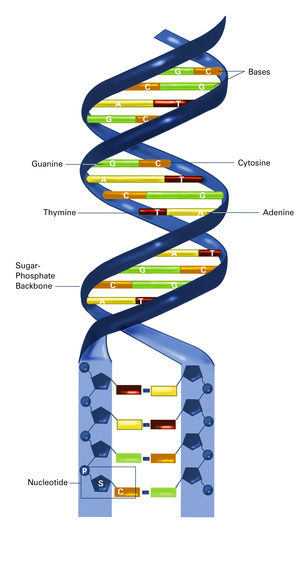
A kromoszómák a sejtek működése során időről időre különféle sérüléseket szenvednek, ennek következtében a DNS-molekula eltörik. A spontán DNS-törések mellett akár genetikailag programozottan is megtörténhet ez a jelenség, például az immunsejtek kialakulásakor, vagy az ivarsejtek képződésekor. A törés ahhoz kell, hogy a DNS-molekula úgynevezett rekombináción menjen keresztül.
A rekombináció a géneket tartalmazó DNS-szakaszok fizikai összekeverését jelenti, amely lényegében az evolúció hajtóereje, ez kell ahhoz, hogy több változat is megjelenhessen egy adott élőlényből. Magát a rekombinációt mindig egy DNS-törés indítja el.
Régóta foglalkoztatja a kutatókat, hogy miért pont ott törik el a DNS, ahol. Ennek nagyon fontos gyakorlati, akár orvosi jelentősége van: például a karcinogenezist, azaz a rák keletkezését is valamilyen DNS-törés indíthatja el. A törések és DNS-rekombinációk szabályozatlan működése vezet ahhoz az elfajzáshoz, amit a sebészek később rákként azonosítanak.
Epigenetikai tényezők
Székvölgyi Lóránt, a Debreceni Egyetem Biofizikai és Sejtbiológiai Intézetének kutatója szerint azt már jó pár éve tudjuk, hogy azokat a forró pontokat, ahol a DNS eltörik, és a rekombináció megtörténik úgynevezett epigenetikai tényezők szabályozhatják.
Mik azok az epigenetikai tényezők? „Ha a DNS egy fonál, és egy ollóval el akarom vágni bizonyos helyeken, akkor egy színes tollal rakok rá mondjuk piros jelzéseket. Amikor arról beszélünk, hogy epigenetikai tényezők határozzák meg a töréseket, akkor a piros jelzésekre gondolunk" – mondja Székvölgyi.
„A DNS-molekulát úgy kell elképzelni, mint egy nagyon hosszú fonalat. Egy sejt nagyon pici, pár mikron a térfogata, az emberi DNS pedig majdnem két méter hosszú. Valahogy bele kell zsúfolni ebbe a pici térfogatba". Ez úgy történik, hogy a DNS rátekeredik bizonyos fehérjékre, például a hisztonokra. Ezek a legfontosabb sejtmagfehérjék, amelyek önmagukban a DNS bepakolását segítik. Ezekre a hiszton fehérjékre úgynevezett hisztonmódosító enzimek jeleket írnak, ezek lesznek az epigenetikai tényezők.
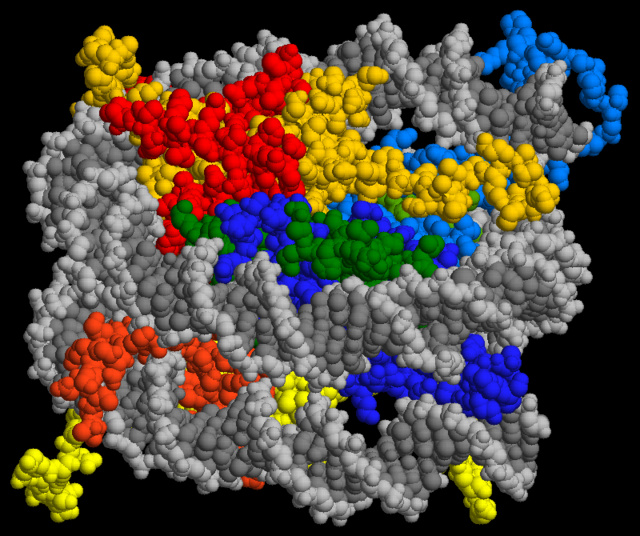
Székvölgyi szerint körülbelül tíz éve tudjuk, hogy ahol a DNS eltörik, ott van egy epigenetikus jelzés. Ez az eredmény azonban eddig csak statisztikai alapon jött ki, az ok-okozati összefüggést senki nem tudta bizonyítani. Ezt az összefüggést tudta igazolni a Science-ben megjelent, a magyar kutató által megosztott első szerzőként publikált, The COMPASS Subunit Spp1 Links Histone Methylation to Initiation of Meiotic Recombination című tanulmány.
Irányított génterápia
A kutatók kísérletükben géntechnológiai úton egy fúziós fehérjét hoztak létre (GBD-Set1), amelyet odairányítottak a DNS-hez, eddig egyedülálló módon, pontosan egy bizonyos régióba. A kutatás fenti eredményén kívül ez a másik hatalmas előrelépés. Az irányított megoldás azért lényeges, mert például a génterápiában, növénynemesítésben nagyon fontos, hogy a kutatók oda vigyenek be egy transzgént (olyan gént amelyet egyik élőlényből a másikba visznek), ahova akarnak.
„Jelenleg a génterápia úgy működik, mint amikor sörétes puskával rálőnénk valakire, gyakorlatilag nem is tudjuk, hogy hova mennek a lövedékek. Az általunk kifejlesztett módszerrel irányítani tudjuk a fehérjéket” – mondta a kutató. A kísérletben használt, irányított fúziós fehérje önmagában rekombinációt tudott kiváltani, a tanulmány szerzői ezzel bizonyították, hogy az epigenetikai jel, konkrétan a H3-as hiszton négyes oldalláncának trimetilazációja (H3K4me3) nemcsak egy statisztikai összefüggés.
Váratlan felfedezés
Amellett, hogy a kutatók bebizonyították az ok-okozati összefüggést a jel és a rekombináció között, volt egy nagyon váratlan felfedezésük is. A rekombincáió eléréséhez a DNS-hez odavitt hisztonmódosító enzim nem önmagában működik a sejtben, hanem egy COMPASS (Complex Associated with Set1) nevű nagy fehérjekomplex része. A COMPASS-nak van egy alegysége, az Spp1 nevű fehérje. „Kiderült, hogy nem is a hisztonmódosító enzim a fontos, ahogy ezt korábban gondoltuk, hanem az Spp1 nevű alegység” – mondja Székvölgyi.
A kutatók a kromatinhoz (a kromoszóma anyaga) irányították az Spp1 fehérjét, és azt találták, a GBD-Spp1 fúziós fehérje minden körülmények között rekombinációt okoz, amely ekkor már teljesen független az epigenetikai jelöléstől és a hisztonmódosító enzimtől is, amely a jelet a kromatinra írja. Az derült ki, hogy közvetlenül nem is a hisztonmódítás, vagy a hisztonmódosító enzim a fontos, hanem az egész COMPASS fehérjekomplexnek egy alegysége, az Spp1 játszik kulcsszerepet.
A kísérleteket ugyan az életsztőmodell-rendszerben végezték a kutatók, eredményeiknek azonban nagyon fontos humán vonatkozásai vannak, mert az Spp1 génnek megvan az emberi megfelelője is. Nagyon valószínű, hogy most olyan kutatások indulnak el, amelyek kifejezetten a humán változatot, a Cfp1-et (CXXC finger protein 1) fogják vizsgálni.
Az, hogy a Cfp1 fehérje ugyanúgy viselkedik az emberi testben, mint az Spp1 az élesztőben, persze még nem bizonyított, a kutató szerint azonban nagy valószínűséggel ugyanolyan szerepet játszik. A tanulmány eredményei nyomán valószínűleg számos, emlősökkel foglalkozó epigenetikai laborban megpróbálják majd reprodukálni az eredményeket.
Rákkutatás és meddőség
Orvosi jelentőségű is lehet a kutatás eredménye: az irányított rekombináció szerepet játszhat a humán meddőség kezelésében is. A DNS-törések nagy mennyiségben keletkeznek az ivarsejtek létrejöttekor, mind a női, mind a hímivarsejtek képzése során. Bizonyos meddő páciensekben éppen az a probléma, hogy azok a gének hibásak, amelyek a törésekben vesznek részt. Egyelőre elmélet, de nem elképzelhetetlen az, hogy ha kutatók géntechnológiai úton, transzgenetikusan be tudnak vinni töréseket az ősivarsejtek DNS-ébe, a meddő páciensek újra egészségesek lehetnek.
Az eredményeknek szerepe lehet a rákkutatásban is. Közismert, hogy a rosszindulatú daganatok kialakulásának hátterében a rekombináció fehérjéinek hibás működése áll. Mivel a rekombináció epigenetikai szabályozás alatt is áll, különösen jelentősek lehet azok a manapság használatos epigenetikai gyógyszerek, amelyekkel próbálják ki- vagy bekapcsolni a rák kialakulását okozó, inaktiválódott vagy kórosan túlműködő géneket.
Ezeket a gyógyszereket általában a daganatos vagy a rákra hajlamosító betegségek kemoterápiás koktéljába adagolják. Ezek a drogok az epigenetikai jeleket befolyásolják: odaírják, vagy törlik azokat. „A mai legmodernebb rákteória szerint a rák nem is genetikai betegség, hanem epigenetikai. Ez azt jelenti, hogy az elindító lépés nem egy génmutáció, hanem egy epimutáció, egy epigenetikai jel hibás törlődése, vagy odaíródása a DNS-re” – fogalmaz a kutató.
A legtöbb rosszindulatú sejtosztódási folyamatban kulcsszerepet játszanak a kontrollálatlan DNS törés-rekombináció ciklusok, amely eredményeként elfajzik a sejt, amit a sebész a végül daganatként azonosít. Itt is kulcskérdés annak megértése, miért ott törnek el a kromoszómák, ahol eltörnek: ha mélyebben megértjük a rekombináció molekuláris összetevőit, akkor talán befolyásolhatjuk azokat gyógyszerekkel vagy akár géntechnológiai eljárásokkal.