Ijesztő, mire lehetünk képesek

További Tudomány cikkek
-
 Megtalálták a másnaposság felelősét, de nem az, amire eddig gyanakodtak
Megtalálták a másnaposság felelősét, de nem az, amire eddig gyanakodtak - Ha nincs vérfrissítés, jönnek a bajok
- Magas rangú katonatiszt tűnt fel a világ legnagyobb hadseregében, de még mindig rejtély, ki irányítja őket
- Végre tényleg megoldódhatott Stonehenge rejtélye
- Még mindig mérgező az 1916-os verduni csata helyszíne
Áprilisban jelentette be egy kínai tudóscsoport, hogy a világon először sikeresen hajtottak végre génmódosítást egy emberi embrión a Crispr nevű génterápiás eljárással. A kutatók módosítottak egy rendellenesen működő gént, ami egy örökletes vérbetegséget, úgynevezett béta-talasszémiát okoz. A beavatkozást mesterséges megtermékenyítéssel (a továbbiakban: IVF, mint In vitro fertilizáció) létrehozott embriókon végezték; ezeket a helyi termékenységi klinikáktól kapták.
Fontos: az embriókból nem válhatott volna életképes csecsemő. Ha nem használják fel őket a tanulmányhoz, még a klinikán kidobták volna őket. És fel sem merült, hogy beültetnék őket egy anyába.
A Junjiu Huang vezette kutatócsoport tanulmányát a Protein and Cell című szaklap hozta le. Más folyóiratoknak is elküldték, de a Nature és a Science etikai kifogásokra hivatkozva visszadobta a cikket – pedig a Nature 2011-ben még az év eljárásának tartotta a génterápiát. Ugyanakkor pont ezekben a lapokban jelent meg az a több kutató által jegyzett cikk, ami a génmódosítás globális moratóriumát követelte. Akkor azt írták: azon túl, hogy etikai aggályaik vannak az efféle beavatkozással kapcsolatban, a terápiás előnyök is elhanyagolhatók.
Nem biztonságos, még nem
Ha génmódosításról van szó, a tudományos élet többnyire azért fogalmaz óvatosan (vagy követel teljes zárlatot), mert a beavatkozás hosszú távú következményei még nem ismertek. Még nem született génmódosított csecsemő, akinek még embriókorában módosították a DNS-ét.
Még nem. De nem árt tudni, hogy előbb lesz lehetőségünk halálpontos génmódosításra, mint közös igényünk ugyanerre. A közelmúltban rengeteg, a pontos génszekvenálást segítő orvosi eszköz készült. Ezek hihetetlen teljesítményű, de egyszerűen használható berendezések; hogy mennyire biztonságosak, és hogy pontosan milyen célra használhatnánk őket, az már más kérdés.

A génmódosítás még akkor is nagy rizikó, ha a berendezések hibátlanul dolgoznak, és a génsebész tudja, hogy mit csinál, mert a módosított gén nemcsak a célszemély életére hatna ki, hanem generációkon át tovább öröklődne. Pedig a módszer legnagyobb előnye pont az örökletes betegségek gyógyítása lenne. Mégis,
Hiszik vagy sem, de még ez is optimista jóslat, elvégre abból indul ki, hogy a beavatkozáshoz adott a technikai háttér és a szakértelem. De pont a kínaiak tanulmánya mutat rá, hogy az eljárás még a legmodernebb eszközökkel sem biztonságos. A kutatók 86 embriónál próbálták meg kijavítani a béta-talasszémia hibás génjét, de csupán az embriók töredékénél volt sikeres a beavatkozás. Ők is tudják, hogy ez ebben a formában kudarc: Huang a Nature-nek azt mondta, hogy ha életképes embriókon alkalmaznák az eljárást, ahhoz közel 100 százalékos hatékonyság kéne.
A londoni King's College őssejtkutatója, Dusko Ilic szerint a kínai tanulmány elsősorban azt bizonyítja, hogy a génterápia egyelőre nem biztonságos. A rosszul elvégzett génmódosítás az egészséges géneket is károsíthatja, szóval hiába a fejlődő technika, ezek még mindig csak kezdeti szárnypróbálgatások. Azt viszont Ilic is támogatja, hogy folytassák a kutatásokat.
Nem állíthatod meg a tudományt. Nem számít, milyen moratóriumot rendelnek el, nem akadályozhatják meg, hogy világszerte folytassák a kutatásokat.
– mondta Ilic. A kínaiak tanulmányát egyébként nem tartja etikátlannak.
Ezeket az embriókat két spermával termékenyítették meg. A világ minden termékenységi klinikája megszabadult volna tőlük. Ez ellen nem lehet etikai kifogást emelni.
Az IVF-klinikákon az orvosok már most is végeznek génvizsgálatot az embriókon; ilyenkor genetikai rendellenességeket keresnek. Az anyákba csak a legegészségesebbeket ültetik be. Viszont ha hatékonyan, biztonsággal lehetne kijavítani a hibás gént, akár a sérült embriókat is meg lehetne menteni.
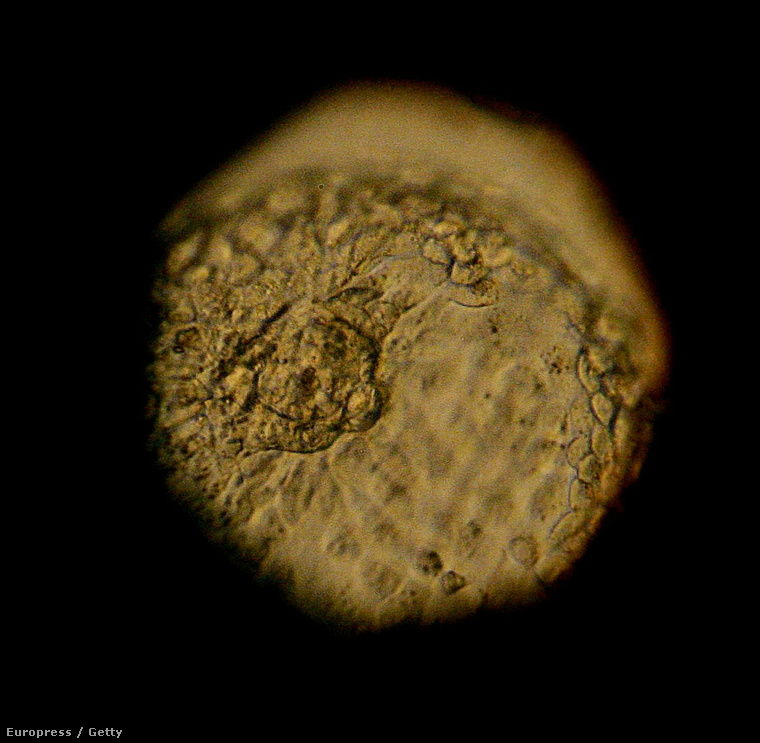
A brit törvények egyelőre tiltják az embriók génmódosítását; ilyeneket nem ültetnének be az anyákba. Egy brit genetikus, aki név nélkül kommentálta a Guardiannek a kínai tanulmányt – mintha méltóságán alulinak érezné, hogy foglalkozik a témával, vagy éppen nem akart túl határozottan állást foglalni –, azt mondta:
Mindenkinek világos volt, hogy az új eljárásokat embereken fogják használni, és hogy előbb-utóbb működni is fognak. Kicsit szenzációhajhász ez a tálalás. És persze, érvelhetünk azzal, hogy milyen hasznos lehet a génterápia az öröklődő betegségek gyógyításában, másfelől viszont nem tudjuk, hogy biztonságos-e. És könnyű megindulni a lejtőn: meddig fog tartani, amíg az emberek megpróbálják megváltoztatni a szemük és a hajuk színét, a magasságukat vagy az intelligenciájukat?
Kínában azzal végeznek kísérleteket, amit a pártvezetés jónak gondol; ha aggályaik vannak, azok valószínűleg inkább technikai, mint etikai jellegűek. De nem csak őket foglalkoztatja a téma. Kathy Niakan őssejtkutató, a londoni Francis Crick Intézet munkatársa arra kérte a brit kormányt, hogy adjon engedélyt az embriók genomjának módosítására, illetve az embriókkal folyatott kísérletezésre. Ezekből továbbra sem születne gyerek: az eredményeket csak tudományos alapkutatásokhoz használnák.
Lesznek még itt etikai viták. De Niakan és munkatársai hamarosan megkaphatják az engedélyt.
A génmódosító eljárások három kategóriára oszthatók:
- A legtámogatottabb a vérképzési rendellenességek gyógyítását, a tüdőbetegségek kezelését, az izomfejlődést célozza.
- A második kategóriába tartozik Niakan munkája is: az emberi spermiumot, petesejtet és embriót módosítaná, de az eredményeket csak genetikai alapkutatásokhoz használnák.
- A legellentmondásosabb terület: olyan génmódosítás, amit IVF-klinikákon használnának, hogy kijavítsák az örökletes betegségeket okozó hibás géneket.
Akik globális moratóriummal reagálnak a génterápiára – és még kutatási célból sem engedélyeznék az eljárást –, elsősorban attól tartanak, hogy a közvélemény ellenük fordul, és még az ennél kevésbé ellentmondásos génmódosítási eljárásoknak is keresztbe tesznek. Pedig ezek vadonatúj gyógymódokat kínálhatnak.
Niakan arra készül, hogy tanulmányozza az embriót a megtermékenyítés utáni napokban. Ilyenkor az embrió sejtbevonatot növeszt magára, amiből később méhlepény lesz. A kutatások annak a megértését segítenék, hogy mi okozhatja egyes nőknél az idő előtti vetélést.
Az így megszerzett tudás nagyon fontos lenne ahhoz, hogy megértsük, hogyan fejlődik egy egészséges emberi embrió. Így jobban megérthetjük a vetélések okát. Ez nem azt jelenti, hogy jöhetnek [a dizájnerbébik], mert az Egyesült Királyság roppant szigorúan szabályozza ezt a területet.
– mondta Niakan.
Az illetékes brit hatóság, a Human Fertilisation and Embryology Authority (HFEA) még nem végzett a kérelem felülvizsgálatával, de várhatóan jóváhagyja majd. (Efféle beavatkozásra csak ők adhatnak engedélyt, de cserébe alapos indoklást várnak.)
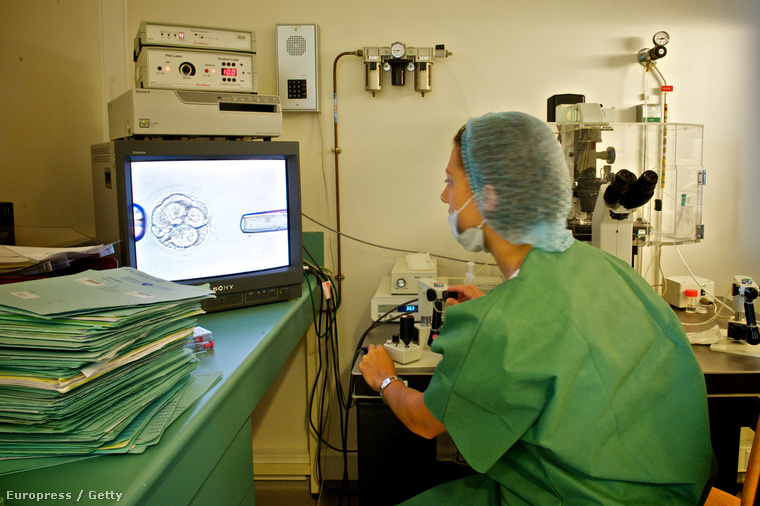
A hatályos törvények értelmében a tanulmányhoz használt embriókat 14 nap után meg kell semmisíteni - ezeket egyébként termékenységi klinikáktól szerezhetik meg, szigorú titoktartás terhe mellett. Niakan reméli, hogy minél előbb megkapják az engedélyt, és elkezdődhet az érdemi munka. Azt még ő sem tudja, hogy a projekt meddig húzódhat el.
Az RNS keres, a CAS9 vág
A génmódosításhoz Niakan is egyre gyakrabban használja a Crispr-Cas9 nevű eljárást. Ennek részletes szakirodalma van; nekünk elég annyit tudnunk, hogy három éve, mióta feltalálták, forradalmasította az orvosbiológiai kutatásokat. A Crispr-Cas9 már egészen precíz változtatásokat végezhet a DNS-ben: akár életet is menthetne, ha sikerülne örökletes betegségekért felelős géneket javítani vele.
Így működik:
- Egy RNS-molekulát, amit egy CAS9 nevű enzimhez csatlakoztatnak, úgy programoznak, hogy találja meg.
- Az RNS csatlakozik a hibás DNS-szakaszhoz, majd a CAS9 mindkét végén elvágja a DNS kettős spirálját.
- A DNS ezek után magától helyreáll; az eljárás azt is lehetővé teszi, hogy egy egészséges DNS-szakaszt illesszenek be a kimetszett rész helyére.
Tudják mit, inkább nézzék meg filmen, az magáért beszél. (Meg angolul.)
A Crispr-Cas9-t Niakan arra használná, hogy a fejletlen embriókban ki- és bekapcsolja a géneket. Mivel ezek a módosítások kihatnak a méhlepényképződésre, a hatásuk is észlelhető. Ezzel a módszerrel tanulmányozni lehetne a gének funkcióit, és így idővel pontosan megérthetnék az embrió működését is.
Az olcsó, könnyen használható és hatékony génmanipulációs eszközök elterjedése sok kutatót tett nyugtalanná. Ők tudják a legjobban, hogy ez a terület túl gyorsan fejlődik ahhoz, hogy túl sokáig figyelembe vegyék az etikai aggályokat. Pedig indokolt az óvatosság, ha tudjuk, hogy a beavatkozással átalakítható az emberi spermium és petesejt is. Mi lesz, ha csak később, mondjuk az eljárás klinikai bevezetése után derül ki, hogy mégsem annyira biztonságos?
És térjünk vissza egy pillanata a dizájnerbébikhez. Mi lesz, ha a család azzal állít be az orvoshoz, hogy nekik szőke szemű, kék hajú fiú kell, legózzák össze a szükséges géneket? Az mennyire lesz etikus?
Az elfogadható és a lehetséges
Az etikai aggályokat épp a hatékonyság söpörheti félre. Egy, a Hinxton Grouphoz tartozó nemzetközi szakértői csoport például nem támogatta, hogy génmódosított embriók szülessenek, de azt megjegyezték, hogy
ha az összes biztonsági, hatékonysági és irányítási feltétel teljesül, akkor talán morálisan is elfogadható lesz az eljárás bevonása az emberi reprodukcióba.
Még akik globális moratóriumot hirdetnek, azok is beláthatják, hogy a génterápiás eljárások értékes kutatási eredményeket adhatnak, és hogy ez nem jelenti azt, hogy kapásból intézményesítenék a részeredményeket. Egy fájdalomcsillapító kifejlesztése és engedélyezése évekig tart: miért lenne könnyebb dolga a génterápiának?
Valószínűleg azért, mert a természettel szembeszállni nagyobb tabu, mint a fejfájással. Az amerikai Nemzeti Egészségügyi Intézet vezetője, Francis Collins szerint az embriók DNS-ének módosítására „általában úgy tekintenek, mint a vonalra, amit nem szabad átlépni”. Ezért az Egyesült Államokban nem kapnak kutatási támogatást az embrionális génmódosítással foglalkozó projektek. Egy másik felmérés viszont azt mutatja, hogy ha az eljárás biztonságossá válik, a génkezelt embriók sokat javíthatnak a közegészségügy helyzetén: nem lenne malária, influenza vagy Alzheimer-kór. A génterápiával, legalábbis elméletben, ez is megoldható.
Niakan szerint ígéretes jelek utalnak rá, hogy a génmódosítással javítani lehet a génhibákat, ellenállóbbá válhatunk betegségekkel szemben, vagy akár vadonatúj képességeket fejlesszünk ki, amik alapvetően nem is találhatók meg az emberben. Ugyanakkor, ahogy mondta,
a társadalmon múlik, hogy mit tart elfogadhatónak: a tudomány csak megmutatja, mi az, ami lehetséges.
Más kutatók reakcióit elnézve úgy tűnik, inkább a tudomány nem tartja elfogadhatónak, hogy lassan mi minden lesz lehetséges. És ami azt illeti, igazuk is van: ha a tudomány mindenhatóságába vetett hit nem társul önkorlátozással, annak könnyen katasztrófa lehet a vége.



